
マイコプラズマとは?
「マイコプラズマ」という用語は、バクテリアのクラスであるモリクテス網(ラテン語で mollis =「柔らかい」、cutis =「皮膚」)の多くのメンバーに対して一般的に使用される俗称です。モリクテスは、細胞壁の欠如と小さなゲノムサイズ(0.5–2.2メガベースペア)を特徴とし、GC(グアニン-シトシン)含有量が低い(20–40 mol%)特徴があります。小さなゲノムのため、マイコプラズマは、ヒト、他の脊椎動物、植物、昆虫を含むさまざまな宿主内や宿主上に共生したり、感染症病原体として存在します。また、好気性または嫌気性条件下で増殖することができます。スピロプラズマがらせん形、マイコプラズマ属の一部のマイコプラズマが端構造(マイコプラズマ・ガリセプティカム、マイコプラズマ・ニューモニア)によるフラスコ状の形状など、形態は多様です。種によっては、マイコプラズマは液体培地で単細胞(マイコプラズマ・アーサリティディス)または、凝集体(アコレプラズマ・ライドローイ、マイコプラズマ・ニューモニア、マイコプラズマ・フェルメンタンス)として成長することがあります。細胞壁がないため、マイコプラズマはペニシリンなどの細胞壁標的抗生物質に対して耐性を持ちます。さらに、一部のマイコプラズマは、液体培地の固体表面(ガラスやプラスチック表面など)上にバイオフィルムを形成することができ、これにより、消毒剤や環境ストレス条件に対する別のレベルの耐性を持つことが知られています。
関連ページ
-
細胞培養におけるマイコプラズマ(汚染)
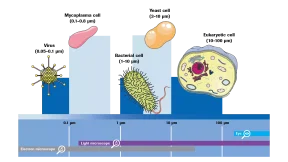
マイコプラズマは臨床的に重要性が高まるだけでなく、細胞培養においても大きな注目を集めています。植物や動物の組織に自然に存在するため、植物由来または動物由来のサプリメントを含むすべての細胞培地は、マイコプラズマによる汚染のリスクがあります。細胞壁がないために形状が可変であり、平均して0.1~0.8μmの小さなサイズのため、マイコプラズマは標準的な滅菌フィルターを通過し、培地や原材料由来の添加物と共に細胞培養に侵入することがあります。
-
一般的な2つの汚染源
最も一般的な2つの汚染源は、実験室の人員と既に汚染された細胞培養からです。後者はクロスコンタミネーションによって汚染物質が伝播されます。マイコプラズマは標準的な光学顕微鏡設定では見えず、通常は細胞培養の状態にほとんど影響を与えないため、しばしば検出されません。それでもなお、細胞の成長と代謝に影響を与え、結果として宿主細胞によって発現される治療用タンパク質に影響を及ぼします。
細胞培養およびバイオファーマプロセスにおいて頻繁に、潜在的に、または時折検出されるマイコプラズマ種
| マイコプラズマ種 | 初回分離源(以下の起源の原材料を使用する製品に関連する) | 細胞培養の汚染物質として頻度が高い(発表された報告書による) | 考えられる汚染源 |
|---|---|---|---|
| Acholeplasma laidlawii | 牛、豚、鳥、植物 | はい | 他の細胞株、牛血清、栄養ブロスパウダー |
| Mycoplasma arginini | 牛、羊、ヤギ、豚 | はい | 他の細胞株、牛血清 |
| Mycoplasma bovis | 牛 | はい | 他の細胞株、牛血清 |
| Mycoplasma fermentans | 人 | はい | 他の細胞株、人員 |
| Mycoplasma gallisepticum | 鳥 | いいえ | 他の細胞株、発育鶏卵 |
| Mycoplasma hyorhinis | 豚 | はい | 他の細胞株、豚トリプシン |
| Mycoplasma orale | 人 | はい | 他の細胞株、人員 |
| Mycoplasma salivarium | 人 | はい | 他の細胞株、人員 |
| Mycoplasma synoviae | 鳥 | いいえ | 他の細胞株、胚化した卵 |
| Spiroplasma citri | 植物 | いいえ | 他の細胞株 |
バイオ医薬品およびATMPの製造プロセスにおけるマイコプラズマ
特に生物製薬および細胞療法産業において、マイコプラズマ汚染の影響は甚大であり、全ての製造バッチを廃棄しなければならず、製造工場は生産を停止しなければなりません。国際的な規制当局は、細胞培養基で調製された予防または治療的臨床使用を目的とする生物製品がマイコプラズマを含まないことを示すためのガイドラインを公表しており、製品の安全性、純度、有効性を確保するために必要です。そのため、マイコプラズマの早期検出は、生物製薬および細胞療法製品の製造プロセスをスムーズにするために不可欠です。
先進療法医薬品(ATMP)は、遺伝子(遺伝子療法)、体細胞(細胞療法)、または組織(組織工学)に基づく新しい治療薬のクラスです。これらの先進的治療法は、多くの疾患の新しい治療法を予示し、したがって、患者にとって莫大なポテンシャルが期待されています。例えば、自己細胞療法は、通常、個々の患者からの細胞の分離、人体外での細胞培養、およびその後の患者への細胞注入を含みます。
生物製薬(またはバイオロジクスとも呼ばれます)は、細菌、酵母、哺乳動物細胞系、または哺乳動物などの生物学的源から製造され、抽出される「古典的な」医薬品です。ワクチン、精製血液成分、および組換えタンパク質がこのカテゴリに属します。これらは、核酸、タンパク質、糖類、およびこれらの複雑な組み合わせから成り、ヒト体内で自然に存在する分子と同一または類似しています。
先進療法医薬品(ATMP)は、遺伝子(遺伝子療法)、体細胞(細胞療法)、または組織(組織工学)に基づく新しい治療薬のクラスです。これらの先進的治療法は、多くの疾患の新しい治療法を予示し、したがって、患者にとって莫大なポテンシャルが期待されています。例えば、自己細胞療法は、通常、個々の患者からの細胞の分離、人体外での細胞培養、およびその後の患者への細胞注入を含みます。
生物製薬(またはバイオロジクスとも呼ばれます)は、細菌、酵母、哺乳動物細胞系、または哺乳動物などの生物学的源から製造され、抽出される「古典的な」医薬品です。ワクチン、精製血液成分、および組換えタンパク質がこのカテゴリに属します。これらは、核酸、タンパク質、糖類、およびこれらの複雑な組み合わせから成り、ヒト体内で自然に存在する分子と同一または類似しています。
マイコプラズマ検出
バイオ医薬品の製造プロセスにおけるマイコプラズマ汚染のテストポイント
原料が汚染されていないことをテストした後(灰色のループ)、バッファーや培地などの溶液が作業培地に適用されると、細胞株や実験室スタッフによってもマイコプラズマ汚染が導入される可能性があるため、汚染をチェックする必要があります(ブルーループ)。また、シード培養と実際の培養中にプロセスコントロールを行うことも推奨されています(薄い紫のループ)。最終的に規定されたテストポイントは、培養のエンドポイントである収穫(紫のループ)です。製品の精製は生きている生物なしに行われるため、収穫物がマイコプラズマフリーの状態であることが証明された後は、通常、さらなるテストポイントは必要ありません。
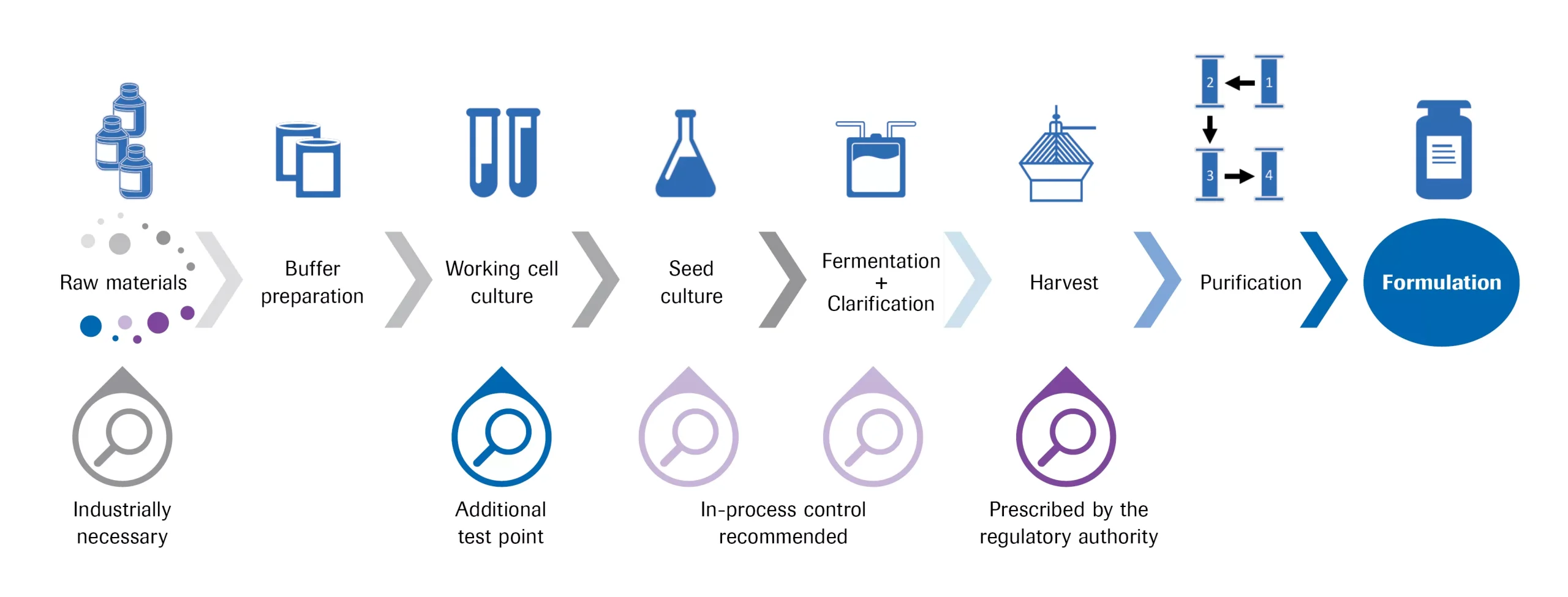
この図は、「古典的な」バイオ医薬品の製造プロセスにおける一般的なテストポイントを示しています。これらの多くのチェックポイントを考慮して、マイコプラズマ検査のための数多くの異なる方法が開発されており、次のセクションで取り上げられます。
方法の概要
非公定法
マイコプラズマ検出の非公定法は、しばしば規制書で求められるサンプルの汚染レベルを検出する感度が不足しています。
さらに、汚染レベルが低い場合、結果の解釈が難しいことがあります。これらのテストは偽陰性の結果を出しやすい傾向があります。
さらに、汚染レベルが低い場合、結果の解釈が難しいことがあります。これらのテストは偽陰性の結果を出しやすい傾向があります。
直接DNA染色法
DNA(デオキシリボ核酸)特異的な蛍光色素で培養物を直接染色する方法は感度が高いですが、マイコプラズマ汚染を検出する目的には推奨されません。このテストは重度に汚染された培養物を確実に検出しますが、低レベルの汚染の解釈はしばしば困難です。細胞培養からのDNAが、マイコプラズマを模倣する小さな蛍光点を生じさせるためです。
酵素ベースの方法
酵素ベースのアッセイは、マイコプラズマの酵素活性を利用する選択的な生化学的テストです。このようなテストがルーチンのマイコプラズマ検査に適用可能であるための前提条件は、測定される酵素活性が理想的にはマイコプラズマ間で普遍的であり、真核細胞のマトリックスでは欠如していることです。
マイコプラズマPCR-ELISA
PCRとその後のELISA(enzyme-linked immunosorbent assay)を組み合わせたアプリケーションが、マイコプラズマPCR ELISAであり、細胞培養中のPCR増幅されたマイコプラズマDNAを検出する光学的酵素免疫アッセイです。PCR反応中に、ジゴキシゲニン標識ヌクレオチドがアンプリコンに組み込まれ、その後のELISAアッセイでの検出を可能にします。マイコプラズマPCR-ELISAテストは、特定のマイコプラズマ種(例えば、M. fermentansとA. laidlawii)に対して1〜3個のマイコプラズマ「粒子」の検出感度を有するとされています。しかし、他のものでは検出限界(LOD)がmlあたり1000「粒子」であったため、このテストはEP規制ガイドラインのマイコプラズマ検出のための公定テストとしての要件を満たしていません。
公定検査方法
これらの方法は、液体培地および寒天培地を使用した従来の微生物学的培養手順に基づく方法と(2法)、迅速な遺伝子検査技術に基づいた方法です。
培養法
従来の培養法は、今日の遺伝子検査技術が使用される前から利用されており、世界中の規制および公定プロトコル(欧州薬局方、米国薬局方、日本薬局方の規制ガイドラインで定式化)に掲載されています。培養法は、マイコプラズマの成長を促進する培地中でのマイコプラズマの特定の培養に基づいています。検査対象のサンプルは、液体マイコプラズマ培養培地および寒天培地に播種され、36 ± 1°C、5.5 ± 0.5% CO2、3 ± 1% O2、90 ± 5% 相対湿度などの微好気性のインキュベーション条件下でマイコプラズマの成長が促進されます。初回接種後21日まで液体培地から寒天プレートへのサブカルチャーが行われます。寒天培地上で、マイコプラズマは微細なコロニー(<100–400 μm 直径)を形成します。
核酸増幅法(NATベース法)
核酸増幅法(NATベース法)には、しばしばPCRによって実施される核酸検出に基づくすべてのテストが含まれます。
指標細胞を用いた培養法(DNA染色法)
指標細胞を用いた培養法は通常、Veroまたは3T3細胞株で行われますが、EP規制ガイドラインにより、マイコプラズマを検出する効果に相当する生産細胞株の使用も受け入れられます。指標細胞培養はサンプルで播種され、35–38°Cでコンフルエントになるまでインキュベートされます。陽性コントロールとして、指標細胞株は、M. oraleのCH19299T株と、テストサンプルの有無にかかわらず、M. hyorhinisのalpha培養種のリファレンス株DBS 1050で接種されます。染色前に、サブカルチャーは適切な固定液で固定され、DNAに結合する蛍光染色液で染色されます。マイコプラズマの存在は、細胞表面の球形蛍光パターンと周囲の強い蛍光によって特徴づけられます。細胞質のミトコンドリアも染色されますが、マイコプラズマから容易に区別されます。陽性コントロールがマイコプラズマに特徴的な蛍光を示さない場合、または陰性コントロールがマイコプラズマに特徴的な蛍光を示す場合、テストは無効となります。
- ページに対する注意事項)
各製品ページに規制上の免責事項が記載されています。



