
バイオ医薬品のプラットフォームとしてのmRNAの革新的な可能性
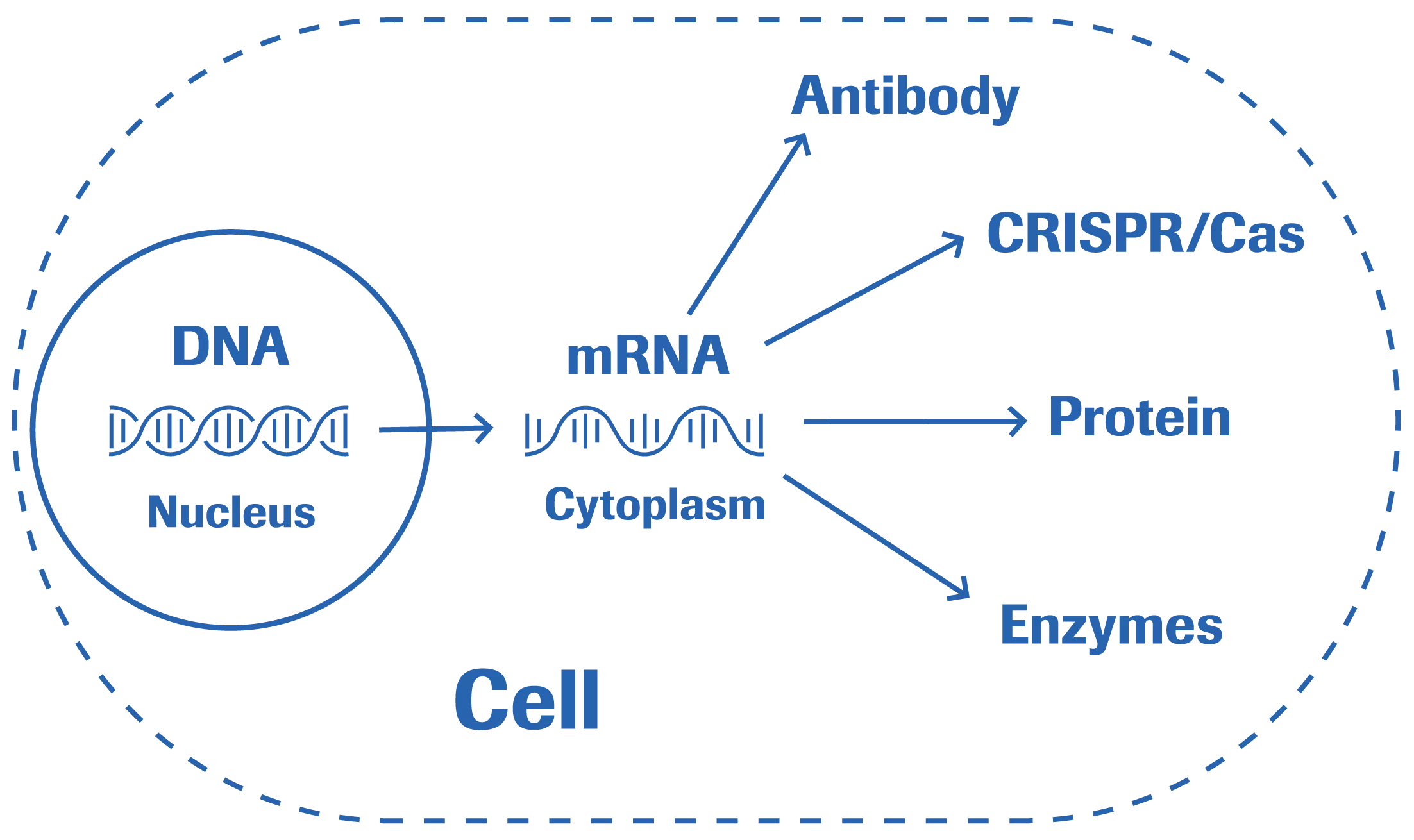
合成メッセンジャーRNA (mRNA)は、治療薬、遺伝子治療、ワクチン用途で魅力的な機会を生み出し、バイオ医薬品企業にとっての新しいプラットフォーム技術です(※1,2,3)。特異的あるいは個別化されたターゲットに対してmRNAを適用することは、高精度医療におけるブレークスルーに繋がります。T7 あるいは SP6 (※4) のようなバクテリオファージの RNA polymerase を用いた mRNA の In vitro 合成により、培養細胞と手のかかる精製ステップによるクルードな細胞集団からのタンパク質の抽出は不要となります。この簡素化されたセルフリーの製造プロセスは、製造スケールの拡大が可能で、比較的短期間で簡単に実用可能です(※5)。治療用タンパク質 および DNAトランスフェクションに対する mRNAテクノロジーの優位点
- 治療用タンパク質の製造にはラージスケールの細胞培養と、各タンパク質毎に特殊で手間のかかる精製プロトコールが必要です
- ミスフォールドした、あるいは不適切に修飾されたタンパク質は、免疫原性や有害な副作用を引き起こすことがあります。
- タンパク質製造のプロセスの複雑さは、しばしば長期にわたる開発サイクルや複雑なGMP対応を必要とします。
- プラスミドDNAのトランスフェクションは活動していない細胞においては効率が低く、特殊なプロモーターと核膜の通過が必要なため複雑です (※6) 。
- mRNAは、コード配列に関わらず同じプロトコルを用いて、標準化された1つのベッセル反応で製造されます(※7)。
- mRNAテクノロジーにより、細胞の細胞質で自然に合成されるのと同様のmRNA分子に類似した人工的なmRNAを合成し、細胞内に目的のタンパク質を一過的に直接届けることが可能です(※8)。
- mRNAテクノロジーにより、単純化されたGMP製造と開発コストの低減が可能です(※9)。
- プラスミドよりも小さな構造物であるmRNAのトランスフェクションプロセスは簡便で効率的です。mRNAは細胞質に直接届けられて発現し、核膜を通過することはありません。
mRNA構造のデザイン

5’ CAP:
5’ UTR/3’ UTR:
CDS:
Poly(A) テール:
ラージスケールのmRNA製造工程
-
1. テンプレートDNAの設計と調製:

mRNAの in vitro 転写のための DNAテンプレートとしては、プラスミド、mRNAから生成したcDNA、オリゴヌクレオチド、あるいはPCR生成物などが使用可能です。テンプレートは、目的配列と、RNA polymerase (T7やSP6など)が結合してRNA合成を開始するための2本鎖のプロモーター領域を含んでいます。プラスミドは自身の組織内で生成、あるいはサードパーティーから購入し、目的のDNA配列がクローニングで挿入されます。
-
2. DNAテンプレートの直鎖化:

Xba I のような制限酵素が、IVTのためのテンプレートの pDNAの直鎖化に使用されます。酵素反応はProteinase Kなどの適切な試薬を用いて停止されます。直鎖化はポリメラーゼのターゲット配列へのアクセスを増やし、生成された転写物が規定された長さと配列となるようにします。あるいは、直鎖状のテンプレートはPCRでも生成されます。
-
3. In vitro transcription 反応:

転写配列に隣接したそれぞれのプロモーター領域に T7, SP6 あるいは T3 RNA ポリメラーゼが結合し、RNAが直鎖状のプラスミドテンプレートから in vito で合成されます (※28)。RNAポリメラーゼはリボヌクレオチド (NTPs) を使用してRNAを合成します。免疫原性を減少させ、転写効率を増加させるために、シュードウリジンや 1-メチルシュードウリジンのような修飾リボヌクレオチドが、しばしば添加されます (※29)。
ラージスケールでの製造への移行には、合成RNAの収量を改善するために転写システムの最適化が必要かもしれません。例えば、リボヌクレアーゼ阻害剤や無生物の pyrophosohatase を添加することで、生成物の収量や品質は明らかに改善します (※30) 。
-
4. Co- or posttranscriptinal 修飾:

成熟型の真核生物mRNAは5’ cap 構造と3’ poly (A) tail を含みます。これらは一般的にIVT中に、あるいは転写後にcapping enzyme とpoly a ポリメラーゼを用いて酵素的に追加されます (※31, 32, 33) 。
-
5. mRNAの精製:
臨床グレードの治療用 mRNA のアプリケーションでは、上流プロセスからの不純物の含有は許容されません。プラスミドDNAはDNase I により酵素的に消化されます。酵素とタンパク質はProteinase K により除去できます。フリーのヌクレオチドや残留酵素、エンドトキシン、二本鎖RNAなどの除去にはクロマトグラフィー法が利用されます。最終的にポリアデニル化されたRNAはオリゴ dT カラム精製で濃縮できます。
-
6. 最終的な製剤化:

mRNAの送達には、核酸をエンドソームから回避し、標的細胞のサイトゾルに取り込むことが必要です。同時に、送達中にエクソソームの RNase によるmRNAの分解を防ぐ必要があります。最も多く利用される送達システムの一つは、lipid nanoparticles (LNPs) を基本としています (※34) 。
mRNA製造における混入物
スケールを簡単に変更できるバイオ医薬品製造のためのプラットフォームテクノロジーであるmRNA製造は、GMP 準拠でなければいけません。これは臨床試験と商品化に対応する安全な製品を入手するために、各バッチ間での一貫性と厳密な品質管理を備えた製造であることを意味します (※35, 36) 。そのため、IVT を含む mRNA 製造で使用される原材料は、慎重に選択しなければなりません。不適切な試薬は、ダウンストリームでの問題に繋がる混入物を持ち込んだり、生成し、効能に影響し、患者への副作用の原因になる場合があります。
一般的な混入物とmRNA製造への影響
RNAポリメラーゼはDNAテンプレートから高いフィデリティ―でRNAを転写します。しかし、転写開始の間に副産物として様々な度合いの二本鎖RNA (dsRNA) が生成されます。これらの副産物は、翻訳を阻害する頑健な I 型インターフェロンの生成や、細胞質のmRNAとリボソームRNA の分解などの、ダウンストリームでの問題(免疫原性)の原因となりえます (※37) 。dsRNA のコンタミネーションはクロマトグラフィー法でmRNA生成物から効率的に除去されます (※38)。
・DNAのコンタミネーション
プラスミド調製からの大腸菌DNAの持ち越し汚染は、mRNA生成物の品質と性能を低下させます。DNase I での消化によりDNAは除去することが可能であり、残存する大腸菌DNAの持ち越し汚染の可能性はqPCRを基本としたResidula DNA E. coli Kit で試験することで除外できます
・RNAの不安定性とRNase コンタミネーション:
RNaseは、プラスミド生成プロセスから持ち込まれる、あるいは不適切な操作で持ち込まれることで、原材料に混入する可能性があります。RNaseは環境中の至る所に存在します。しかし、製造中のそれらの存在は、高度に精製された原材料により除外され、それらの活性はRNase インヒビターで阻害されます (39)。RNAの切断は、6を超える pH、あるいはIVT中や原材料からの混入物でもちこまれるMg2+のような金属イオンの存在でも発生します(※40)。適切な精製と正しい原材料の選択が、安定で翻訳的に活性のあるmRNAを生成するための鍵となります。
研究室と工業スケール間のギャップを埋める
工業的スケールやバイオ医薬品目的のためには、全体的なプロトコルと構成のデザインを最適化しなければならず、工程はGMP要件に適合しなければなりません。GMP 医薬品製造の厳密な製造の一貫性、品質および安全性の許容誤差のためには、免疫原性と安定性を管理するための適切な精製法と材料だけでなく、各プロセス段階において高品質な原材料の供給元が求められます。
mRNAアプリケーション
個別化医療(例: がん免疫療法)
細胞治療
mRNAアプリケーション
タンパク質補充
希少疾患(例: 酵素の補充)



mRNAワクチン・医薬品原料
mRNA合成ワークフローにとって不可欠な原材料製品
医薬品製造用途に最適な性能を有する GMP Grade の mRNA試薬
- ページに対する注意事項)
規制上の免責事項は各製品ページに記載されています。
- 出典元の記載)
-
- (※1)The Limitless Future of RNA Therapeutics. Front. Damase, T.R., Sukhovershin, R., Boada, C.; Taraballi, F., Pettigrew, R.I., Cooke, J.P. Bioeng. Biotechnol. 2021, 9, 628137.
- (※2)Nucleic Acid Delivery for Therapeutic Applications. Gupta, A., Andresen, J.L., Manan, R.S., Langer, R. Adv. Drug Deliv. Rev. 2021, 178, 113834.
- (※3)Theoretical Basis for Stabilizing Messenger RNA through Secondary Structure Design. Wayment-Steele, H.K., Kim, D.S., Choe, C.A., Nicol, J.J., Wellington-Oguri, R., Watkins, A.M., Parra Sperberg, R.A., Huang, P.-S., Participants, E., Das, R. Nucleic Acids Res. 2021, 49, 10604–10617.
- (※4)In vitro transcription of long RNA containing modified nucleosides. Pardi, N., Muramatsu, H., Weissman D., Karikó K. Methods Mol Biol. 2013, 969, 29-42.
- (※5)A Development That May Evolve into a Revolution in Medicine: MRNA as the Basis for Novel, Nucleotide Based Vaccines and Drugs. Kallen, K.-J., Theß, A. Ther. Adv. Vaccines 2014, 2, 10–31.
- (※6)Therapeutic Prospects of mRNA-Based Gene Therapy for Glioblastoma. Tang, X., Zhang, S., Fu, R., Zhang, L., Huang, K., Peng, H., Dai, L., Chen, Q. Front Oncol. 2019, 8;9, 1208.
- (※7)Developing mRNA-vaccine technologies. Schlake T, Thess A, Fotin-Mleczek M, Kallen KJ. RNA Biol. 2012;9(11):1319-1330. doi:10.4161/rna.22269
- (※8)mRNA-based therapeutics — developing a new class of drugs. Sahin, U., Karikó, K. & Türeci, Ö. Nat Rev Drug Discov 13, 759–780 (2014).
- (※9)mRNA vaccines — a new era in vaccinology. Pardi, N., Hogan, M., Porter, F. et al. Nat Rev Drug Discov 17, 261–279 (2018).
- (※10)The promise of mRNA vaccines: a biotech and industrial perspective. Jackson, N.A.C., Kester, K.E., Casimiro, D., Gurunathan, S., DeRosa, F. npj Vaccines 2020, 5, 11.
- (※11)Lipid-Based MRNA Vaccine Delivery Systems. Midoux, P., Pichon, C. Expert Rev Vaccines 2015, 14, 221–234.
- (※12)The cap and poly(A) tail function synergistically to regulate mRNA translational efficiency. Gallie DR. Genes Dev. 1991, 5, 2108–2116.
- (※13)Half-lives of beta and gamma globin messenger RNAs and of protein synthetic capacity in cultured human reticulocytes. Ross J, Sullivan TD. Blood. 1985, 66, 1149–1154.
- (※14)Modification of antigen-encoding RNA increases stability, translational efficacy, and T-cell stimulatory capacity of dendritic cells. Holtkamp, S., Kreiter, S., Abderraouf, S., Simon, P., Koslowski, M., Huber, C., Türeci, Ö., Sahin, U. Blood. 2006, 108, 4009–4017.
- (※15)Codon bias confers stability to human mRNAs. Hia F, Yang SF, Shichino Y, Yoshinaga M, Murakawa Y, Vandenbon A, Fukao A, Fujiwara T, Landthaler M, Natsume T, Adachi S, Iwasaki S, Takeuchi O. EMBO Rep. 2019, 20, e48220.
- (※16)The molecular basis of coupling between poly(A)-tail length and translational efficiency. Xiang K, Bartel DP. Elife. 2021, 10, e66493.
- (※17)Suppression of RNA recognition by Toll-like receptors: the impact of nucleoside modification and the evolutionary origin of RNA. Karikó K, Buckstein M, Ni H, Weissman D. Immunity 2005, 23, 165–175.
- (※18)Startups set off new wave of mRNA therapeutics. Dolgin, E. Nat Biotechnol 39, 1029–1031 (2021). https://doi.org/10.1038/s41587-021-01056-6
- (※19)mRNA-based therapeutics — developing a new class of drugs. Sahin, U., Karikó, K. & Türeci, Ö. Nat Rev Drug Discov 2014, 13, 759–780.
- (※20)Enhanced Protein Expression by Internal Ribosomal Entry Site-Driven MRNA Translation as a Novel Approach for in Vitro Loading of Dendritic Cells with Antigens. Tan, X., Wan, Y. Hum. Immunol. 2008, 69, 32–40.
- (※21)Cloned poliovirus complementary DNA is infectious in mammalian cells. Racaniello, V. R. & Baltimore, D. Science 214, 916–919 (1981).
- (※22)mRNA-based therapeutics — developing a new class of drugs. Sahin, U., Karikó, K. & Türeci, Ö. Nat Rev Drug Discov 2014, 13, 759–780.
- (※23)An Alphavirus Replicon Particle Chimera Derived from Venezuelan Equine Encephalitis and Sindbis Viruses Is a Potent Gene-Based Vaccine Delivery Vector. Perri S, Greer CE, Thudium K, Doe B, Legg H, Liu H, et al. J Virol (2003) 77:10394–403. doi: 10.1128/jvi.77.19.10394-10403.2003
- (※24)Self-Amplifying RNA Vaccines Give Equivalent Protection against Influenza to mRNA Vaccines but at Much Lower Doses. Vogel AB, Lambert L, Kinnear E, Busse D, Erbar S, Reuter KC, et al. Mol Ther (2018) 26:446–55. doi: 10.1016/j.ymthe.2017.11.017
- (※25)Amplifying RNA Vaccine Development. Fuller DH, Berglund P. N Engl J Med. 2020 Jun 18;382(25):2469-2471. doi: 10.1056/NEJMcibr2009737. PMID: 32558474.
- (※26)Polymeric and lipid nanoparticles for delivery of self-amplifying RNA vaccines. Blakney AK, McKay PF, Hu K, Samnuan K, Jain N, Brown A, Thomas A, Rogers P, Polra K, Sallah H, Yeow J, Zhu Y, Stevens MM, Geall A, Shattock RJ. J Control Release. 2021 Oct 10;338:201-210. doi: 10.1016/j.jconrel.2021.08.029. Epub 2021 Aug 18. PMID: 34418521; PMCID: PMC8412240.
- (※27)Self-amplifying RNA vaccines for infectious diseases. Bloom, K., van den Berg, F. & Arbuthnot, P. Gene Ther 28, 117–129 (2021). https://doi.org/10.1038/s41434-020-00204-y
- (※28)Preventing T7 RNA Polymerase Read-through Transcription-A Synthetic Termination Signal Capable of Improving Bioprocess Stability. Mairhofer, J., Wittwer, A., Cserjan-Puschmann, M., Striedner, G. ACS Synth. Biol. 2015, 4, 265–273.
- (※29)Suppression of RNA recognition by Toll-like receptors: the impact of nucleoside modification and the evolutionary origin of RNA. Karikó, K., Buckstein, M., Ni, H., Weissman, D. Immunity 2005, 23, 165–175.
- (※30)Use of inorganic pyrophosphatase to improve the yield of in vitro transcription reactions catalyzed by T7 RNA polymerase. Cunningham, P.R., Ofengand, J. Biotechniques. 1990, 9, 713-4.
- (※31)Synthesis and properties of mRNAs containing the novel “anti-reverse” cap analogs 7- methyl(3′-O-methyl) GpppG and 7-methyl(3′-deoxy) GpppG. Stepinski, J., Waddell, C., Stolarski, R., Darzynkiewicz, E., Rhoads, R. E. RNA 2001, 7, 1486–1495.
- (※32)Synthesis of anti-reverse cap analogs (ARCAs) and their applications in mRNA translation and stability. Grudzien-Nogalsky, E., Stepinski, J., Jemielity, J., Zuberek, J., Stolarski, R., Rhoads, R.E., Darzynkiewicz, E., Meth. Enzym. Ch. 2007, 431, 203–227.
- (※33)Modification of RNA by mRNA guanylyltransferase and mRNA (guanine 7) methyltransferase from vaccinia virions. Martin, S., Moss, B. J. Bio Chem. 1975, 250, 9330–9335.
- (※34)Materials for non-viral intracellular delivery of messenger RNA therapeutics. Kauffman, K.J., Webber, M.J., Anderson, D.G. J Control Release 2016, 240, 227–234.
- (※35)COVID-19 Vaccine Development during Pandemic: Gap Analysis, Opportunities, and Impact on Future Emerging Infectious Disease Development Strategies. Rele, S. Hum. Vaccin. Immunother. 2021, 17, 1122–1127.
- (※36)Development of mRNA Vaccines: Scientific and Regulatory Issues. Knezevic, I., Liu, M.A., Peden, K., Zhou, T., Kang, H.-N. Vaccines 2021, 9, 81.
- (※37)An origin of the immunogenicity of in vitro transcribed RNA. Mu, X., Greenwald, E., Ahmad, S., Hur, S. Nucleic Acids Res. 2018, 46, 5239-5249.
- (※38)HPLC purification of in vitro transcribed long RNA. Weissman, D., Pardi, N., Muramatsu, H., Kariko, K. Methods Mol Biol. 2013, 969, 43–54.
- (※39)Characterization of the ribonuclease activity on the skin surface. Probst, J., Brechtel, S., Scheel, B., Hoerr, I., Jung, G., Rammensee, H.G., Pascolo, S. Genet Vaccines Ther. 2006, 4, 4.
- (※40)Non-enzymatic RNA hydrolysis promoted by the combined catalytic activity of buffers and magnesium ions. AbouHaidar ,M.G., Ivanov, I.G. Z Naturforsch C J Biosci. 1999, 54, 542–548.
- (※41)Pascolo, S. Messenger RNA. The Inexpensive Biopharmaceutica. J Multidiscip. Eng. Sci. Technol. 2017, 4, 6937.
- (※1)The Limitless Future of RNA Therapeutics. Front. Damase, T.R., Sukhovershin, R., Boada, C.; Taraballi, F., Pettigrew, R.I., Cooke, J.P. Bioeng. Biotechnol. 2021, 9, 628137.

