
バイオ医薬品製造に最適な In Vitro Glycoengineering (IVGE)
モノクローナル抗体(mAbs)のFcのグリコシル化が生物学的活性に及ぼす影響は、広く議論され、多くの研究で調査されてきました。糖鎖種の違いが治療用タンパク質の生物学的活性に異なる影響を与えることが知られています(※1)。しかし、特定の糖鎖バリアントが生物学的活性にプラスの影響を与えるとしても、そのようなグリコシル化のパターンを一貫して生産することは容易ではありません。細胞株工学やバイオプロセスの最適化によって、グリコシル化の均一性を高めたり、少なくとも部分的にはある程度特定の糖鎖パターンを達成することは可能です。しかし、これらの最適化は時間がかかる上、抗体の収量など、他の重要なパラメーターを損なう可能性があります。さらに、このような手間のかかるアプローチを用いて、特定の糖鎖パターンを持つmAbsを分析的に必要な量で生産することは経済的ではありません。現在、この問題は In Vitro Glycoengineering(IVGE)を使用することで解決できます。ダウンストリームプロセスにおいて治療用タンパク質に適用できるため、この技術は細胞株やバイオプロセスから独立しています。歴史的には、IVGEに必要な試薬であるグリコシルトランスフェラーゼが十分な量と優れた品質で入手できなかったため、このアプローチは広く追求されませんでした。バイオ医薬品業界がIVGEを利用して治療用タンパク質のグリコシル化プロファイルを大幅に改善できるように、最近、Roche DiagnosticsとRoche Pharmaは、シアル酸転移酵素 (Sialyltransferase) とガラクトシル転移酵素 (Galactosyltramsferase) を開発しました。
本アプリケーションノートでは、治療用タンパク質の開発、製造、分析のための IVGE (In Vitro Glycoengineering) 技術の適合性評価について説明します。 アプリケーションノート,
April, 2016
Sebastian Malik, Marco Thomann
Pharma Technical Development Penzberg;
Roche Diagnostics GmbH; Penzberg, Germany
糖鎖命名法
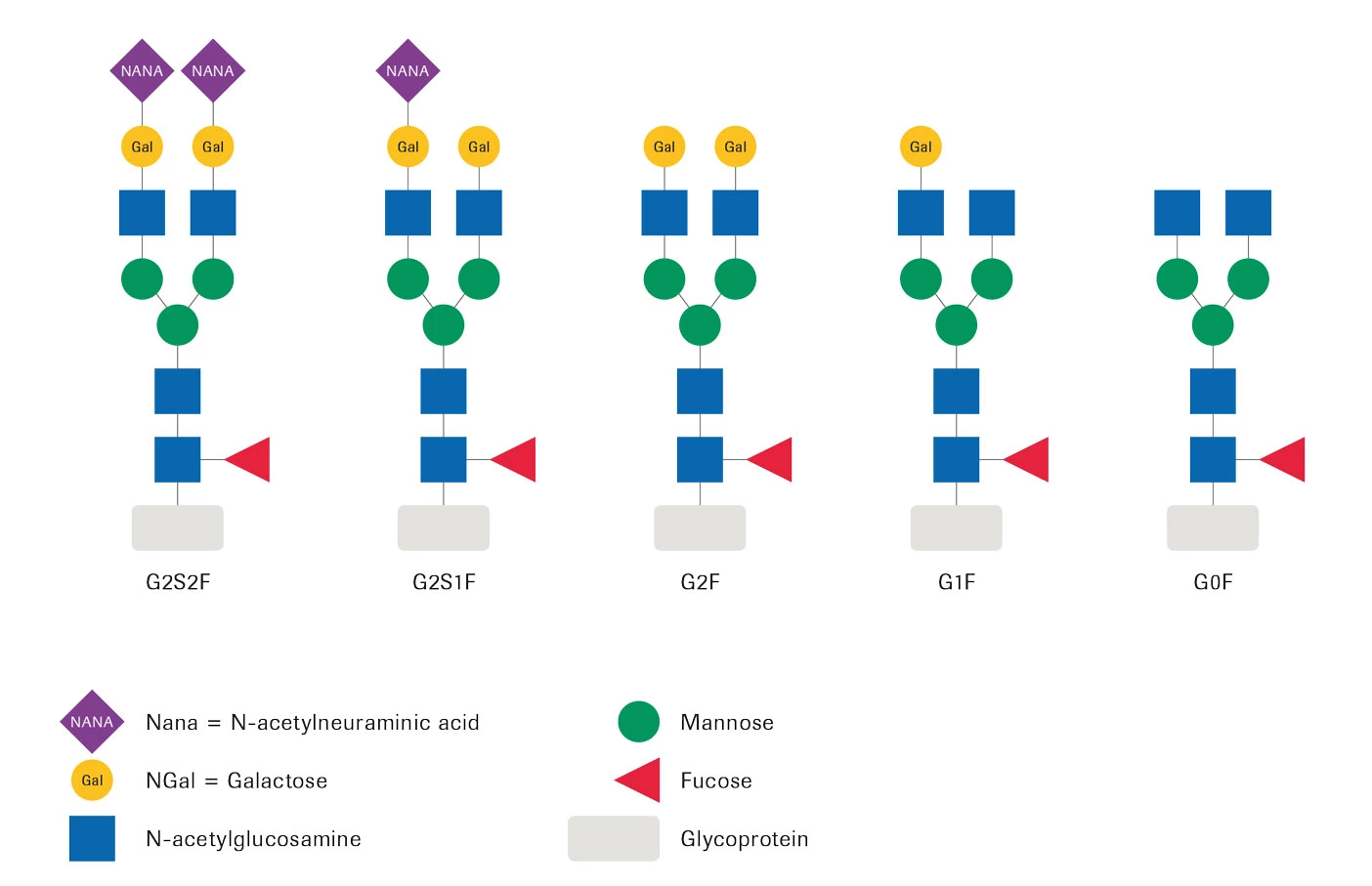
評価に最も関連すると考えられるパラメーターは以下の通りです:
・酵素活性
・製造プロセスへの実装
・酵素の汎用性
・医薬品開発におけるスケールと品質の向上
グリコシルトランスフェラーゼの酵素活性
β-1,4-ガラクトシルトランスフェラーゼ、GalT1を使用したガラクトシル化
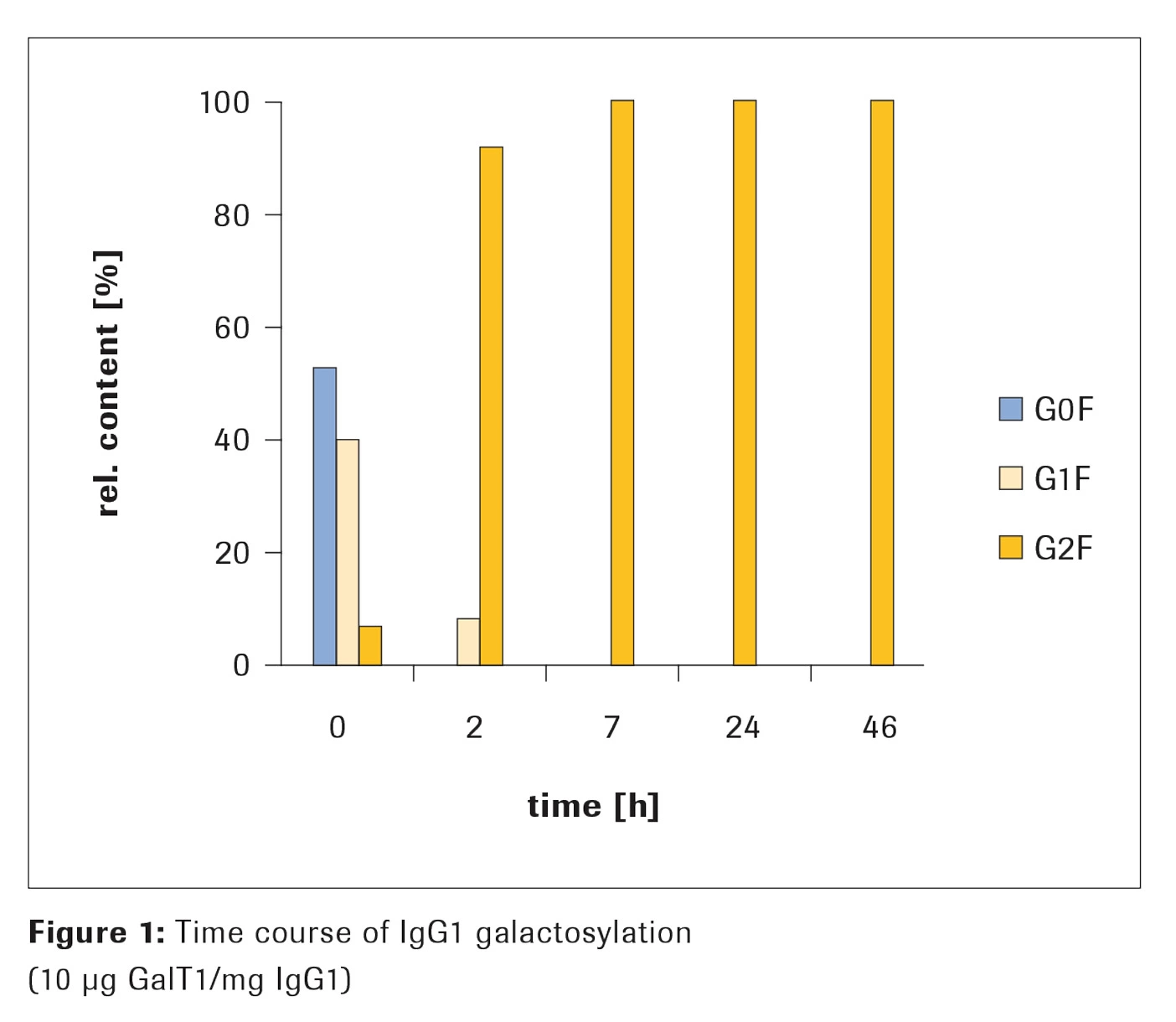
方法
1mgのIgG1を、Appendix の手順に従ってガラクトシル化しました。ガラクトシル化の進行をモニターするため、異なる時間で一部を分取し、ガラクトシル化の程度を質量分析で解析しました。
結果
反応開始サンプルは異なる糖鎖パターンを示していました。ガラクトースがないもの(G0F)、ついでガラクトースが1つ付いたもの(G1F)が多く、2重ガラクトシル化のバリアント(G2F)は相対量が10%未満でした。完全なG2F化は、7時間の反応時間後に達成されました(図1)。2時間のインキュベーション後、主要となったのはG2F糖鎖で、相対量は90%以上でした。
α-2,3-シアリルトランスフェラーゼ、ST3を使用したシアリル化
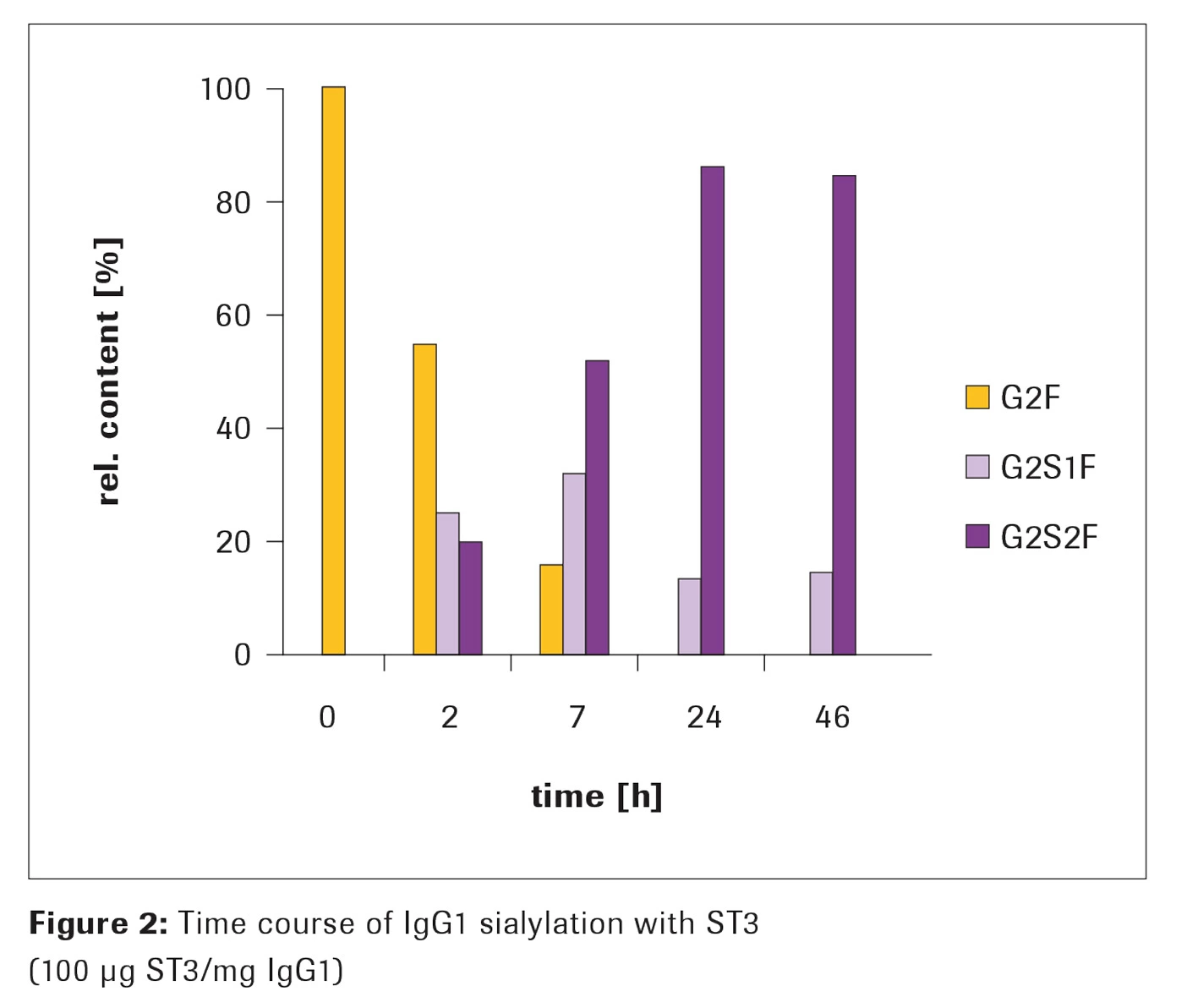
方法
1mgのIgG1を、Appendix の手順に従ってシアリル化しました。シアリル化の進行をモニターするため、異なる時間で一部を分取し、シアリル化の程度を質量分析で解析しました。
結果
24時間後、相対量として 約85%のG2S2Fと約15%のG2S1F が得られ、46時間のインキュベーション後も変わりませんでした(Figure 2)。完全にガラクトシル化されたIgG1 (G2F)を出発分子として使用しました。2時間後、糖鎖の組成は、25%のG2S1Fと20%のG2S2Fとなりました。
シアル酸含量はインキュベーション時間とともに増加し、約24時間後に定常状態に達しました。アルカリホスファターゼ(AP)を反応に添加しない場合、シアリル化は約7時間以上のインキュベーション時間で減少しました(データ非掲載)。
α-2,6-シアリルトランスフェラーゼ、ST6を使用したシアリル化
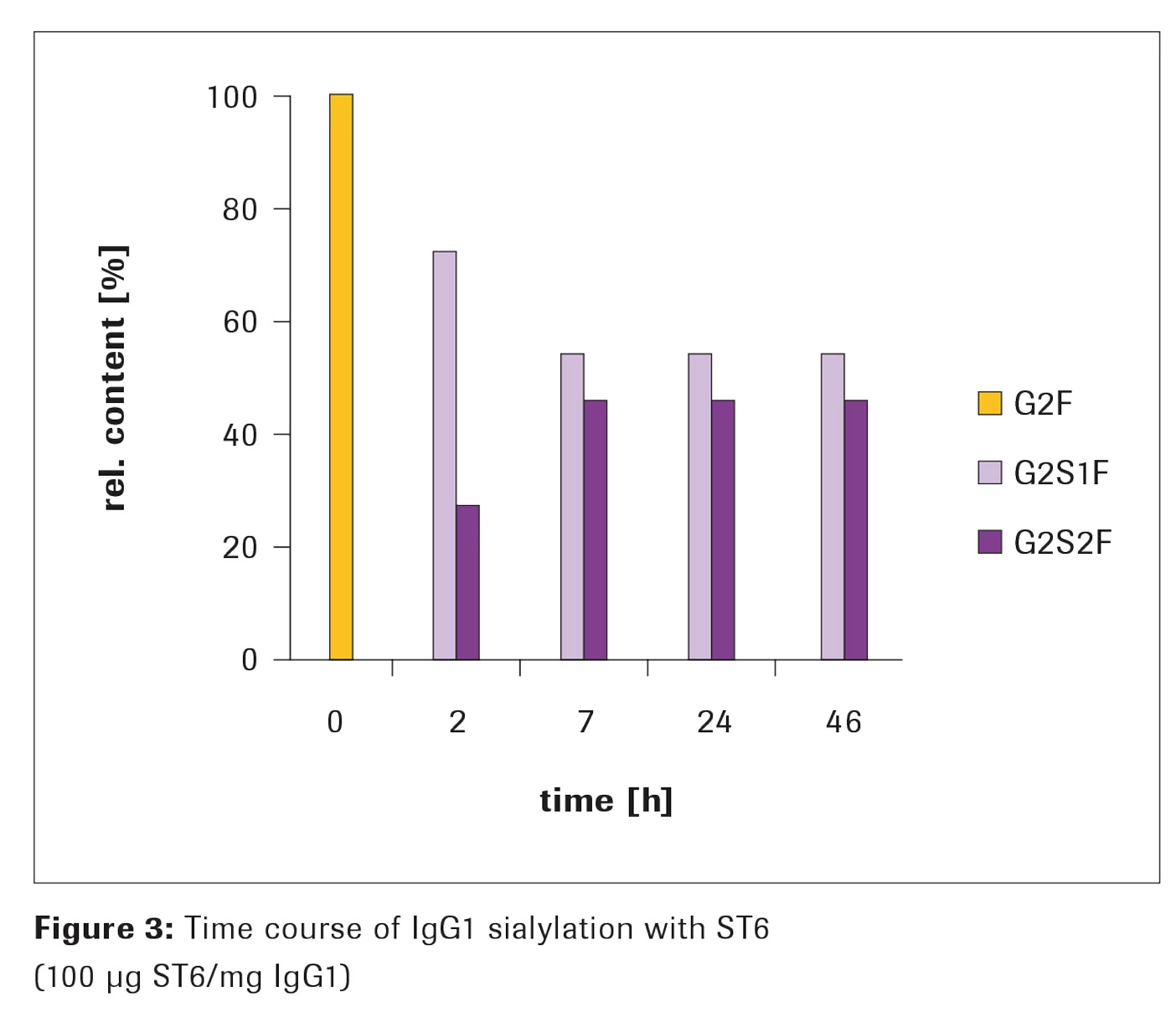
方法
1mgのIgG1を、Appendix の手順に従ってシアリル化しました。質量分析を使用してシアリル化の進行を解析しました。完全にガラクトシル化されたIgGがアクセプター分子として使用されました。
結果
2時間後、糖鎖の組成は72%のG2S1Fと28%のG2S2Fでした。G2S2F化はインキュベーション時間とともにさらに増加し、定常状態に達しました。約7時間のインキュベーション後、最大のシアリル化レベルに達しました:46%のG2S2Fと54%のG2S1Fであり、46時間のインキュベーション後も変わりませんでした(Figure 3)。アルカリホスファターゼ(AP)を反応に添加しない場合、約7時間以上のインキュベーション時間でシアリル化が減少することが観察されました(データ未掲載)。
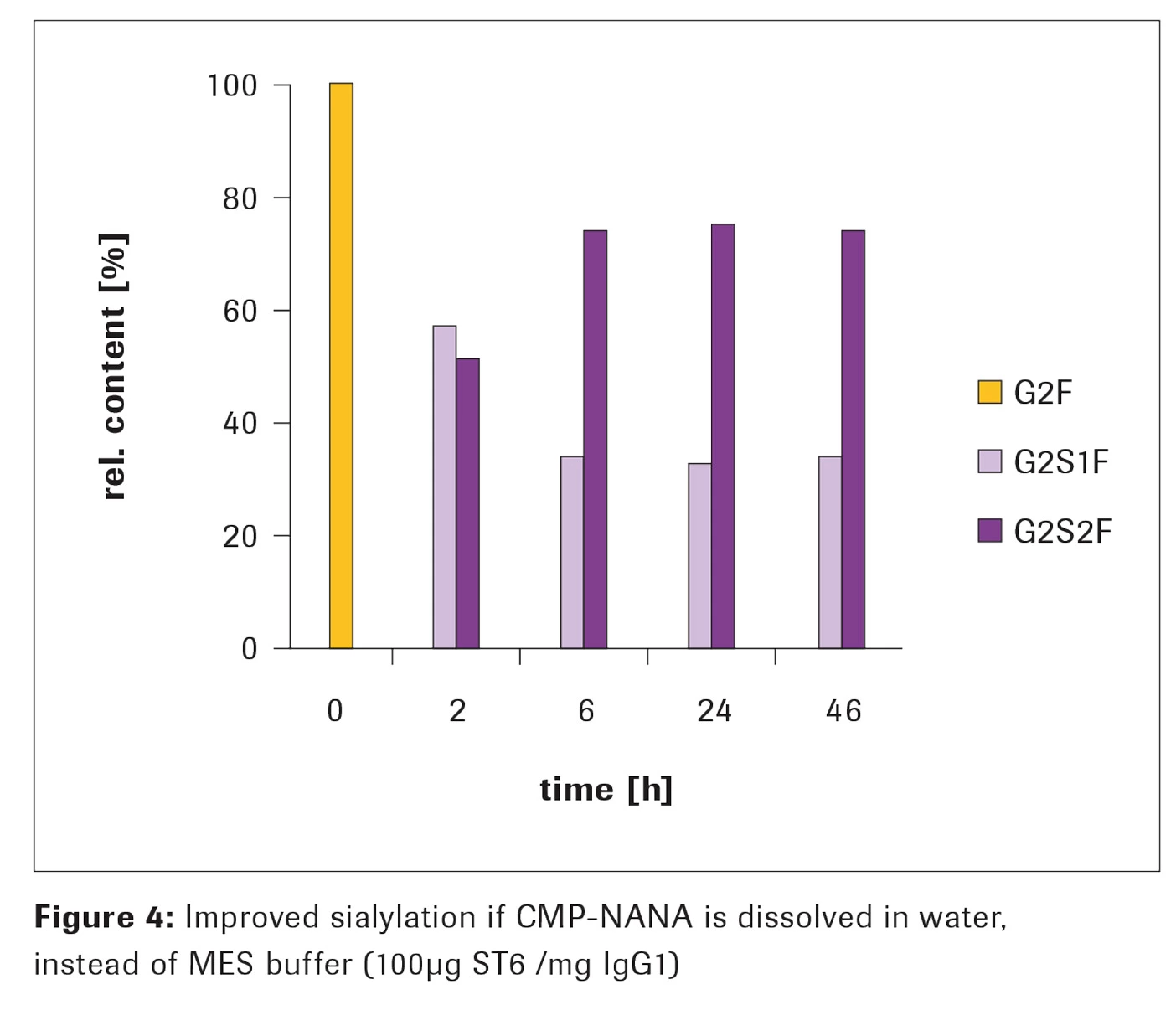
ST3またはST6を使用したシアリル化は非常に信頼性が高く、堅牢であり、わずかに異なるバッファーシステムでも問題なく実施できることが示されました。ただし、反応混合物のpHがpH 6から7の間であることが重要です。Figure 3 のデータはMESバッファーでの反応から得られました。しかし、イオン強度が低い反応では、最大シアリル化レベルが70%のG2S2Fまで増加することがあります(Figure 4)。
製造プロセスへの実装
次にコストと時間の観点からも、特にラージスケールのアプリケーションでは、2つのIVGEステップ(ガラクトシル化、シアリル化)を精製することなく1つの反応容器で実行できることは重要な要素です。
これらの両方に対応するために、異なる精製プロセスステップからのIgG1(:培養上清、プロテインA溶出液、および高度に精製されたバルク溶液)に対してガラクトシル化とシアリル化の両方の反応を同時に行いました(Figure 5)。
ガラクトシル化とシアリル化を同時に実施(”1-pot-reaction”)
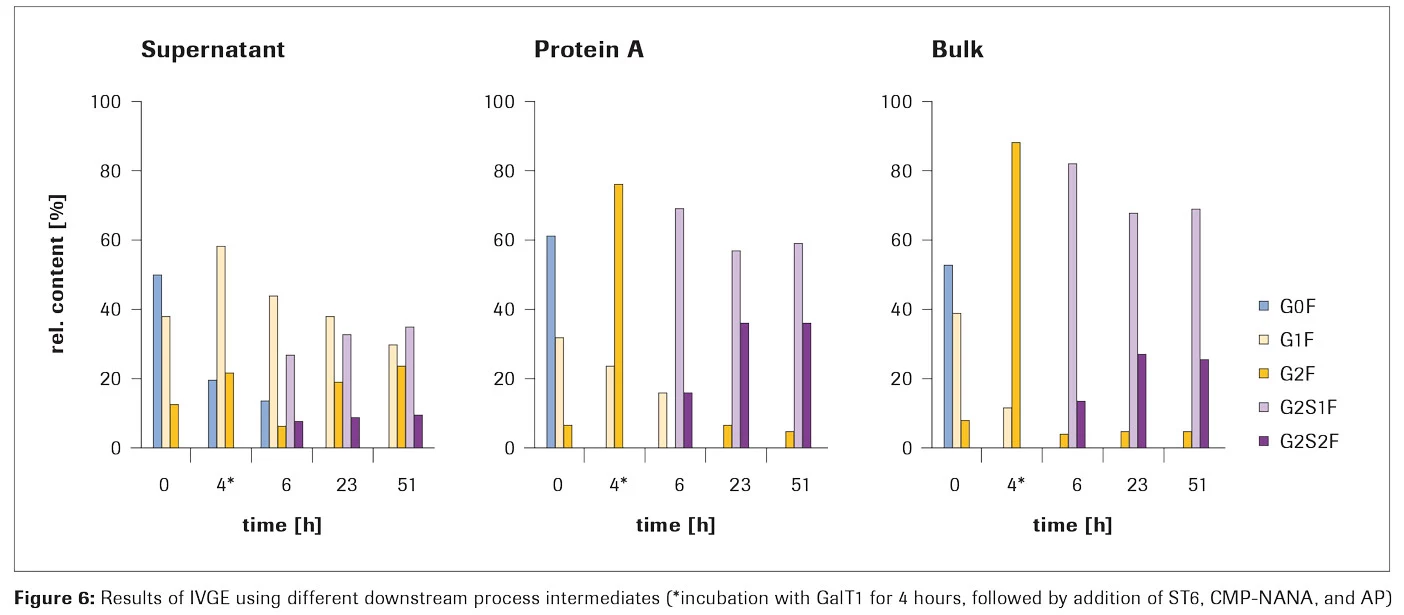
1mgのIgG1をそれぞれ含む精製済みのバルク原料、プロテインA溶出液、および培養上清に対して、間に精製のステップを含むことなくガラクトシル化およびシアリル化を実施しました(手順は Appendix を参照) 。グリコシル化の進行は、異なる時間で一部を分取し、質量分析による後続の解析でモニターしました。
結果
すべての3つのサンプルで、最大の二分岐シアリル化 (G2S2F) が23時間後に達成されました(Figure 6)。1ポットプロセスでの最大のシアリル化レベルは、プロテインAサンプルとバルクサンプルの両方で、約30%のG2S2Fと60%のG2S1Fを示しました。培養上清サンプルではレベルがはるかに低かったため、プロテインAで精製された原料またはバルク原料の使用が推奨されます。
酵素の汎用性
医薬品開発における品質とスケールの向上
当社の糖鎖転移酵素は、以下の重要な要件を満たしています:
・スケーラビリティ:酵素はリクエストに応じてkg単位で提供可能です。
・品質:酵素はリクエストに応じてGMP品質で提供できます。
・Animal-free ステータス:培養、精製、および最終的な製品のすべてにおいて、動物由来の原材料は使用されていません。
要点と展望 - バイオ医薬品業界における IVGE の応用
In vitro glycoengineering (IVGE) の工程は、プロテインAで精製されたIgG1で示されたように、既存のダウンストリームプロセスに統合できます。
糖鎖転移酵素と活性化された糖は、リクエストに応じてGMP品質でanimal-free の大量生産が可能であり、臨床材料のためのカスタマイズができます。また、臨床材料への IVGE後の酵素の除去の成功をモニタリングするための残留酵素テスト(ELISA形式)も開発中です。私たちの考えでは、ルーチンな製造プロセスへの適用のための前提条件は満たされていると考えています。IVGEプロセスを製造スケールで実行可能とするには、各アプリケーションに対して、試験および最適化する必要があります
Appendix
IgGのガラクトシル化
反応バッファーの調製: 10 mM UDP-Gal、5 mM 塩化マンガン(II)(MnCl2)、および100 mM MESを含む(pH 6.5)。
・61 mg UDP-Gal、6.3 mg MnCl2、および195 mg MESを6 mlの水に溶解します。
・pHを6.5に調整し、最終体積を10 mlに水で調整します。
2.
ガラクトシル化反応の準備: 976 μg UDP-Gガラクトース、10 μg ガラクトシルトランスフェラーゼ、および1 mg IgGを含む。
・160 μl 反応バッファー
・33.3 μl IgG(30 mg/ml、pH 6)
・1.8 μl ガラクトシルトランスフェラーゼ
・4.9 μl 水
3.
反応液を37℃でインキュベーションし、質量分析のために一部を分取し、チューブを-15℃から-25℃で凍結して反応を停止します。
ST3 あるいは ST6 を使用したIgGのシアリル化
反応バッファーの調製: 6.1 mM CMP-NANA、および200 mM MES(pH 6.5)を含む。
・40 mg CMP-NANAと390.4 mg MESを6 mlの水に溶解します。
・ pHを6.5に調整し、最終体積を10 mlに水で調整します。
2.
シアリル化反応の準備: 500 μgのCMP-NANA、100 μgのシアリルトランスフェラーゼ、および1 mgのIgGを含む。
・125 μl 反応バッファー
・100 μl IgG(10 mg/ml、pH 6)
・18 μl シアルトランスフェラーゼ(ST3またはST6)
・2.8 μl アルカリホスファターゼ(1 mg/ml)
・2.53 μl ZnCl2溶液(10 mM)
・1.67 μl 水
3.
反応液を37℃でインキュベーションし、質量分析のため一部を分取し、チューブを-15℃から-25℃で凍結して反応を停止します。
ガラクトシル化とシアリル化の同時反応(”1-pot-reaction”)
ガラクトシル化反応の準備: 976 μg UDP-Gガラクトース、10 μg ガラクトシルトランスフェラーゼ、および1 mg IgGを含む。
・160 μl 反応バッファー
・33.3 μl IgG(30 mg/ml、pH 6)
・1.8 μl ガラクトシルトランスフェラーゼ
・4.9 μl 水
2.
反応液を4時間、37℃でインキュベーションし、この反応液の50 μlを質量分析のために分取します。
3.
残りの150 μlのガラクトシル化されたIgGに、シアル化のための試薬を追加し、375 μg CMP-NANA、75 μg シアリルトランスフェラーゼ、および0.75 mg IgGを含むシアル化反応を設定します。
・94 μl 反応バッファー
・13.6 μl シアリルトランスフェラーゼST6
・2.9 μl アルカリホスファターゼ(1 mg/ml)
・2.6 μl ZnCl2溶液(10 mM)
4.
反応液を37℃でインキュベーションし、解析のため一部を分取し、チューブを-15℃から-25℃で凍結して反応を停止します。
注意:IgG濃度が異なる場合は、プロトコルを適応させる必要があります。考慮する最も重要なパラメータは、活性化された糖、IgG、および糖鎖転移酵素の質量比です。
- ページに対する注意事項)
各製品ページに規制上の免責事項が記載されています。
- 出典元の記載)
-
- (※1) Post-translational modifications in the context of therapeutic proteins, Gary Walsh & Roy Jefferis, Nat Biotechnol. 2006 Oct;24(10):1241-52
- (※2) In vitro glycoengineering of IgG1 and its effect on Fc receptor binding and ADCC activity, M. Thomann et al., PLoS One. 2015 Aug 12;10(8):e0134949
- (※1) Post-translational modifications in the context of therapeutic proteins, Gary Walsh & Roy Jefferis, Nat Biotechnol. 2006 Oct;24(10):1241-52

